
PD Dr. Johannes Rheinlaender
Postdoc
| Raum: | C9 A38 |
| Telefon: | +49-7071-29-76031 |
| Telefax: | +49-7071-29-5093 |
| E-Mail: |
Arbeitsschwerpunkte
| Rasterkraftmikroskopie (RKM) |
| Entwicklungen in der Rasterionenleitungsmikroskopie (RILM) und erweiterte Anwendungen |
| Finite-Element-Modellierung (FEM) in der Rastersondenmikroskopie |
| Zellmechanik |
| Biostatistik |
Zusammenfassung
Das Verständnis der Mechanik der lebenden Zelle als kleiner Baustein des Lebens ist von großer Relevanz in den modernen Biowissenschaften, da sich Zellmechanik als kritischer Aspekt in zahlreichen Prozessen in sowohl gesunden als auch kranken Zellen erwiesen hat. Zum Beispiel ist die Zellmechanik beteiligt in vielen grundlegenden Zellfunktionen wie Adhäsion, Migration, Gewebe- und Organentwicklung und Differenzierung. Darüber hinaus sind auch viele Krankheiten mit einer Veränderung der Mechanik auf der Einzelzellebene assoziiert. 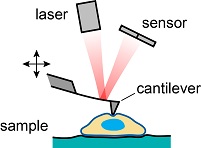 Schema eines AFM für Zellabbildungen. Jedoch sind viele Zusammenhänge in diesen Prozessen noch nicht vollständig verstanden, was zu einem großen Teil begründet ist durch einen Mangel an quantitativen Methoden zur Untersuchung von lebenden Zellen auf mikroskopischer Skala. Rastersondenmikroskope, besonders das Rasterkraftmikroskop (englisch: atomic force microscope, AFM) und das Rasterionenleitfähigkeitsmikroskop (scanning ion conductance microscope, SICM), sind ideal geeignet für diesen Zweck, da sie die Untersuchung von lebenden Zellen unter physiologischen Bedingungen erlauben. Das AFM (siehe Schema rechts) ist ein etabliertes Gerät für die Zellabbildung und basiert darauf einen Federbalken mit Nanometer-scharfer Spitze in Kontakt mit der Probe zu bringen. Dieser direkte Kontakt erlaubt dann auch mechanische Untersuchungen der Probe mit Auflösung bis auf die Nanometer-Skala. Aktuell erweitern wir das AFM für nano-rheologische Messungen von viskoelastischen Probeneigenschaften. 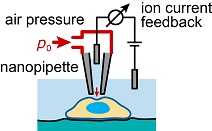 Schema eines SICM für Das SICM ist eine weniger bekanntes Rastersondenmikroskop und beruht auf dem Messen des Ionenstroms durch eine gläserne Nanopipette (siehe Schema links). Aufgrund des kontaktfreien Abbildungsprinzip ist es besonders geeignet für weiche und empfindliche Proben wie lebende Zellen. Da viele zentrale technische Aspekte des SICM noch unbekannt sind, haben wir auch den Abbildungsprozess des SICM untersucht, beispielsweise das Auflösungsvermögen und das Ionenstrom-Abstandsverhalten. Darüber hinaus entwickeln wir Methoden zur mechanischen Untersuchung von Proben mit dem SICM, zum Beispiel indem mithilfe einer mikrofluidischen Strömung durch die Nanopipette die Probe lokal verformt wird (siehe Schema). Wir kombinieren dabei das kontaktfreie Abbildungsprinzip mit quantitativen nanomechanischen Messungen, was sich als eine vielversprechende Technik für die Untersuchung der lebenden Zell und ihres Cytoskeletts erweist (siehe Bilder unten). 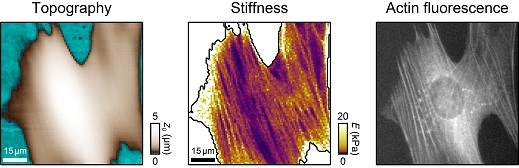 SICM-Steifigkeitsabbildung einer lebenden Fibroblastzelle mit Topographiebild (links) und Aufgrund der komplexen Geometrie können viele rastersondenmikroskopische Methoden nicht analytisch beschrieben werden. Ich entwickele daher numerische Ansätze um das Verhalten von AFM und SICM zu untersuchen. 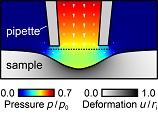 FEM-Modell von Flüssigkeitströmung, Beispielsweise haben wir die Finite-Elemente-Methode (FEM) benutzt, um den mikrofluidische Strömung bei SICM-Steifigkeitsabbildungen zu beschreiben (siehe Modell links). |
Lebenslauf
| 2021 | Habilitation am Fachbereich Physik, Universität Tübingen |
| Seit 2016 | Akademischer Rat am Institut für Angewandte Physik, Universität Tübingen |
| 2016 | Visiting PostDoc Department of Physiology, Development and Neuroscience, University of Cambridge, GB |
| 2011-2016 | Wissenschaftlicher Mitarbeiter am Institut für Angewandte Physik, Universität Tübingen |
| 2012 | Promotion (Physik) |
| 2008-2011 | Wissenschaftlicher Mitarbeiter am Lehrstuhl für Angewandte Physik, Universität Erlangen-Nürnberg |
| 2007 | Physik-Diplom |
| 2003-2007 | Studium der Physik an der Universität Münster |
Auszeichnungen / Stipendien
| 2018 | Lehrpreis für die beste Lehrveranstaltung im Studiengang 'Biomedical Technologies' |
| 2017 | Lehrpreis als bester Dozent im Studiengang 'Biomedical Technologies' |
| 2016 | DFG-Stipendium zur Unterstützung des Aufbaus internationaler Kooperationen |
| 2015 | Lehrpreis als bester Dozent im Studiengang 'Biomedical Technologies' |
| 2015 | DGfB-Reisestipendium EBSA 2015 |